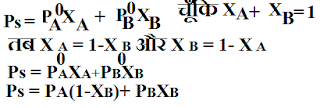Table of Contents
Toggle- CLASS 12 CHEMISTRY PART -01
- CHPATER -01 [ठोस अवस्था ]
- CHAPTER-01 PART-01 [ NOTES ]
- CHAPTER-01 PART-02 [ NOTES ]
- CHAPTER -01 PART-03 [NOTES]
- द्विविमा में निविड संकुलन (Close Packing in Two Dimensions)
- (क) Square Close Packing in Two Dimension (द्विविम में वर्ग निविड़ संकुलन)
- (ख) Two Dimensional Hexagonal Close Packing (द्विविम षटकोणीय निविड संकुलन)
- (ख) द्विविम षटकोणीय निविड संकुलित परतों से त्रिविम निविड संकुलन
- #21:-रिक्तियों की संख्यां (Number of voids)
- #24 :-यौगिक का सूत्र तथा संपूरित रिक्तियों की संख्या (Formula of a Compound and Number of Voids Filled)
- CHAPTER -01 PART-04 [NOTES]
- CHPTER-01 PRT-05 [NOTES ]
- CHAPTER -02 [विलयन ]
- CHAPTER-02 PART-01 [NOTES]
- CHAPTR-02 PART-02 [NOTES]
- CHAPTER-02 PART-03 [NOTES]
- CHPATER-02 PART-04 [NOTES]
- CHAPTER-02 PART-05[NOTES]
यदि आप chemistry से घबराते है तो आप बिलकुल गलत है क्योंकि chemistry एक एसा विषय है जो बहुत कम समय डेली पढने से बहुत अच्छे मार्क्स देता है जी हाँ जैसा आप पढ़ रहे है वैसा ही है , अगर आप डेली chemistry को बहुत कम टाइम देते है तो यकीं मानिये आपकी chemistry की प्रोग्रेस इनती फ़ास्ट होगी की आप नही समझ पाएंगे की कब आप इतने इंटेलीजेंट हो गये 1
Class 12 chemistry में दो भाग जिनमे कुल 16 इकाईया है . अलग अलग प्रकाशन की बुक्स में लेखक अपने हिसाब से इकाइयों का वर्गीकरण करता है ,बुक में कुल अध्याय 31 थे लेकिन लेटेस्ट अपडेट के करान इनमे कुछ कमी हो गयी है हम आपको latest syllabus के हिसाब से नोट्स provide कर रहे है 1
CLASS 12 CHEMISTRY PART -01

CLASS 12 CHEMISTRY PART -01 में कुल 9 चैप्टर है जिन्हें इकाइयों में बाँट कर रखा है और सबसे ज्यादा न्यूमेरिकल भी इसी पार्ट्स में है अत: आपसे गुजारिस है की आप इस पार्ट्स को पुरे ध्यान से पढ़े और अगर कोई भी प्रॉब्लम आपको होती है तो आप कॉमेंट्स करके उसका समाधान पूछ सकते है
CHPATER -01 [ठोस अवस्था ]
CHAPTER-01 PART-01 [ NOTES ]
WELCOME TO FUTURE ZONE ACADEMY
CHAPTER-01 PART-02 [ NOTES ]
#8:-क्रिस्टलीय ठोस के प्रकार:-यह चार प्रकार के होते हैं1
1)- आयनिक ठोस 2)- सह संयोजक ठोस 3)- आणविक ठोस 4)-धात्विक ठोस
1)- आयनिक ठोस:- इस प्रकार के ठोसो में आयन पाए जाते हैं जो सामान्यतः धनायन व ऋण आयन होते हैं यह प्रबल विद्युत आकर्षण बल के द्वारा जुड़े रहते हैं इसी कारण इनका गलनांक तथा क्वथनांक अधिक होता है1
नोट :- आयनिक ठोस अवस्था में विद्युत का कुचालक होते हैं जबकि गलित अवस्था में सुचालक होते हैं क्योंकि ठोस अवस्था में इनमें मुक्त आयन नहीं होते जबकि गलित अवस्था में मुक्त आयन होते हैं जो आदेश वाहक का गमन करते हैं 1
जैसे:-NaCl,KBr,NaOH,CaF2 MgO,CaCl2 आदि 1
नोट:- सोडियम क्लोराइड क्रिस्टल घनाकार होता है इसमें Na+ व् Cl- की उपसहसयोजन संख्या 6 होती है 1
2)- सह संयोजक ठोस:-इन्हें नेटवर्क ठोस के नाम से भी जाना जाता है यह ठोस उदासीन परमाणुओं से मिलकर बने होते हैं जो एक दूसरे से सह्सयोजी आबंध द्वारा जुडे रहते हैं1 यह सामान्य ताप पर विद्युत का कुचालक होते हैं
जैसे:- हिरा ग्रेफाइट सिलिकॉन कार्बाइड बोराजऑन आदि
नोट:- ग्रेफाइट विद्युत का सुचालक होता है जबकि हीरा नहीं क्योंकि ग्रेफाइट की संरचना में एक कार्बन परमाणु की तीन संयोजकताए अन्य कार्बन परमाणु के साथ जुड़ी रहती हैं और एक शेष रह जाती है जो मुक्त आयन का काम करती है ग्रेफाइट की एक और विशेषता होती है यह अच्छे स्नेहक की तरह कार्य करता है क्योंकि इसकी संरचना परतदार होती है जो एक दूसरे के ऊपर आसानी से फिसलती रहती हैं1
3)- आणविक ठोस :-यह तो सामान्यत है अणुओं से मिलकर बने होते हैं उनके मध्य कोई भी आबंध नहीं होता है इन्हें सामान्य तीन भागों में बांटा गया है-1)-अध्रुवीय आणविक ठोस 2)-ध्रुवीय आणविक ठोस 3)- हाइड्रोजन आबंधित ठोस
a )-अध्रुवीय आणविक ठोस:- इस प्रकार के ठोसो में अवयवी कण उदासीन परमाणु होते हैं ये विद्युत के कुचालक होते हैं-
जैसे-H2 ,Cl2, I2 , He ,Au आदि
b)-ध्रुवीय आणविक ठोस :- इस प्रकार के ठोसो में अवयवी कण सह सयोंजी आबंध द्वारा जुड़े रहते हैं1 ये भी विद्युत के कुचालक होते हैं-
जैसे:-HCl, ठोस SO2,ठोस NH3 आदि
c )- हाइड्रोजन आबंधित ठोस :-इस प्रकार के ठोसो में अवयवी कण सह सयोंजी आबंध द्वारा जुड़े रहते हैं1 ये भी विद्युत के कुचालक होते हैं यह केवल तब बनते हैं जब हाइड्रोजन अधिक विद्युत ऋणआत्मक तत्वों के साथ जुड़ता है जैसे फ्लोरीन ऑक्सीजन और नाइट्रोजन आदि इसके सामान्य उदाहरण अमोनिया(NH3),जल(H2O) और हाइड्रोजन फलोराइड(HF) है 1
4)धात्विक ठोस :- ये ठोस धातु परमाणु से मिलकर बने होते हैं इनके अंदर सामान्यत: धात्विक चमक ,विद्युत और ऊष्मा की चालकता, तन्यता और आघातवर्धनीयता जैसे गुण पाए जाते हैं
जैसे:- लोहा, तांबा, टीन ,सोना आदि धात्विक ठोस होते हैं
#9:- विषम दैषिक गुण :-क्रिष्ट्लीय ठोसो में कुछ गुण जैसे –– विद्युत चालकता , अपवर्तनाक , उष्मीय प्रसार आदि सभी दिशाओ में असमान होते है इन पदार्थो का यह गुण विसमदैषिक गुण कहलाता है 1
#10:-त्रिविम जालक :– इसे क्रिष्ट्ल जालक के नाम से भी जाना जाता है अर्थात क्रिष्ट्ल की ज्यमिति दर्शाने के लिए आकाश में परमाणुओं आयनों अथवा अणुओ की जो नियमित पुनरावर्ती होती है उसे त्रिविम जालक कहते है 1
नोट:- कुल 14 त्रिविम जालक संभव होते है इन्हें ब्रेवे जालक कहते है 1
#12:-क्रिष्ट्ल जालक के लक्ष्ण :-इसके लक्ष्ण निम्नलिखित है –
1)-जालक में उपस्थित प्रत्येक बिंदु एक जालक बिंदु अथवा जालक स्थल कहलाता है 1
2)- जालक में उपस्थित प्रत्येक बिंदु एक अवयवी कण को प्रदर्शित करता है 1
3)-जालक बिन्दुओ को सीधी रेखा से जोड़ने पर जालक की ज्यमिति व्यक्त होती है 1
#13:-एकक कोष्ठिका :-त्रिविम में किसी क्रिष्ट्ल का वह न्यूनतम अंश जिसको बार बार दोहराने पर दिए गये पदार्थ का क्रिष्ट्ल जालक बनता है , एकक कोष्ठिका कहलाती है 1
#15:-एकक कोष्ठिका के प्रकार :- ये सामान्यत: दो प्रकार की होती है
1)-आध एकक कोष्ठिका 2)- केन्द्रित एकक कोष्ठिका
1)-आध एक्क्क कोष्ठिका :-वह एकक कोष्ठिका जिसमे अवयवी कण केवल कोणों पर उपस्थित होते है आध एकक कोष्ठिका कहलाती है
2)-केन्द्रित एकक कोष्ठिका :-वह एकक कोष्ठिका जिसमे अवयवी कण कोनो पर उपस्थित होने के साथ साथ किसी केंद्र पर भी उपस्थित हो केन्द्रित एकक कोष्ठिका कहलाती है 1
अ) फलक केन्द्रित एकक कोष्ठिका :-इसमें अवयवी कण कोनो पर उपस्थित होने के साथ साथ प्रत्येक फलक के केंद्र पर भी उपस्थित हो ते है 1
ब) अंत: केन्द्रित एकक कोष्ठिका:–इसमें अवयवी कण कोनो पर उपस्थित होने के साथ साथ केंद्र पर भी उपस्थित हो ते है
CHAPTER -01 PART-03 [NOTES]
WELCOME TO FUTURE ZONE ACADEMY
#17:- एकक कोष्ठिका में अवयवी कणों की संख्या :- इसे ज्ञात करने के लिए कणों का योगदान कितना होता है यह जानना भुत जरूरी होता है –
कानो का योगदान :-
1:-जब कण कोने पर होता है तो वह 1/8 योगदान देता है
2:- जब कण फलक पर होता है तो वह 1/2 योगदान देता है
3:-जब कण केंद्र पर होता है तो वह 1 योगदान देता है
आध या सरल एकक कोष्ठिका में अवयवी कणों की संख्या :- इस प्रकार की कोष्ठिका में कण केवल कोणों पर होते है इसलिए कुल कण = कणों का योगदान * कणों की संख्या
= (1/8) * 8
= 1
अंत: केन्द्रित एकक कोष्ठिका में अवयवी कणों की संख्या :- इस प्रकार की कोष्ठिका में अवयवी कण कोणों के साथ साथ केंद्र पर भी होते है
इसलिए कुल कण = कोणों पर + केंद्र पर
= (1/8)*8 + 1
= 1+1
= 2
फलक केन्द्रित एकक कोष्ठिका में अवयवी कणों की संख्या :- इस प्रकार की कोष्ठिका में अवयवी कण कोणों के साथ साथ फलक के केंद्र पर भी होते है
इसलिए कुल कणों की संख्या = कोणों पर कण +फलक पर कण
= (1/8)*8 + (1/2)*6
= 1+ 3
= 4
अन्त्य केन्द्रित एकक कोष्ठिका में अवयवी कणों की संख्या :- इस प्रकार की कोष्ठिका में अवयवी कण कोणों के साथ साथकिन्ही दो सम्मुख फलक के केंद्र पर भी होते है
इसलिए कुल कणों की संख्या = कोणों पर कण +फलक पर कण
= (1/8)*8 + (1/2)*2
= 1+ 1
= 2
#18 :- धातु क्रिष्टल में निविड़ संकुलन :- जब अवयवी कण इस प्रकार संकुलित होते है की इनका आयतन निम्नतम रहे ताकि घनत्व सर्वाधिक प्राप्त हो सके तो संकुलन निविड़ संकुलन कहलाता है ये सामान्यत: निम्न प्रकार का होता है-
एक विमा में संकुलन :-एक विमा में ठोसों के अवयवी कणों की निविड संकुलन की केवल एक विधि हो सकती है।

द्विविमा में निविड संकुलन (Close Packing in Two Dimensions)
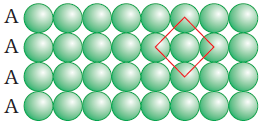
(क) Square Close Packing in Two Dimension (द्विविम में वर्ग निविड़ संकुलन)
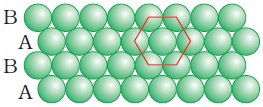
(ख) Two Dimensional Hexagonal Close Packing (द्विविम षटकोणीय निविड संकुलन)
(ख) द्विविम षटकोणीय निविड संकुलित परतों से त्रिविम निविड संकुलन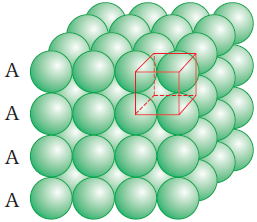
(i) द्वितीय परत को प्रथम परत के ऊपर रखकर
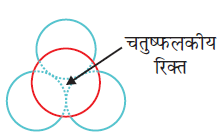
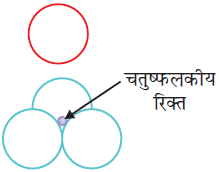
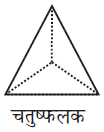
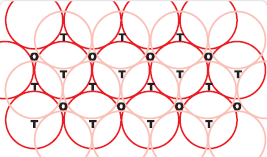 पहली जब भी द्वितीय परत का एक गोला प्रथम परत की रिक्ति के ऊपर अथवा नीचे होता है तो एक चतुष्फलकीय रिक्ति उत्पन्न होती है। इस प्रकार बने रिक्तियों को चतुष्फलकीय रिक्तियाँ (Tetrahedral voids) कहते हैं।
पहली जब भी द्वितीय परत का एक गोला प्रथम परत की रिक्ति के ऊपर अथवा नीचे होता है तो एक चतुष्फलकीय रिक्ति उत्पन्न होती है। इस प्रकार बने रिक्तियों को चतुष्फलकीय रिक्तियाँ (Tetrahedral voids) कहते हैं।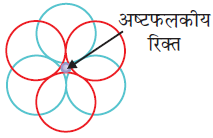
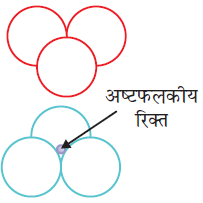
#21:-रिक्तियों की संख्यां (Number of voids)
#24 :-यौगिक का सूत्र तथा संपूरित रिक्तियों की संख्या (Formula of a Compound and Number of Voids Filled)
CHAPTER -01 PART-04 [NOTES]
WELCOME TO FUTURE ZONE ACADEMY
CHEMISTRY CH -01 PART -04
#27:- ठोसो में अपुर्णताये :- किसी क्रिष्टल ,ए से सही क्रम में उपस्थित अवयवी कण का प्रथक होना अथवा सही क्रम में उपस्थित न होना दोष कहलाता है इसे क्रिष्टल दोष और ठोसो में अपूर्णता भी कहते है
#28 :- क्रिष्टल दोष के प्रकार :-
क्रिष्टल दोष सामन्यत: दो प्रकार का होता है :- 1 ) बिंदु दोष 2) रे खिय दोष
बिंदु दोष :- किसी क्रिष्ट्लीय पदार्थ में से किसी बिंदु के चारो और आदर्श व्यवस्था से उत्पन विचलन बिंदु दोष कहलाता है 1
रेखीय दोष :- क्रिष्टल जालक की पूर्ण पंक्तियों में उपस्थित आदर्श विन्याश से उपस्थित विचलन रेखीय दोष कहलाता है 1
#29:- बिंदु दोष के प्रकार :- बिंदु दोष तीन वर्गो में बनता गया है –
1:- स्टाचियोमिट्रिक दोष 2:- अशुधता दोष 3:- नॉन स्टाचियोमिट्रिक दोष
1:- स्टाचियोमिट्रिक दोष:– ये वे बिंदु दोष है जो क्रिष्टल की स्टाचियोमिट्रि को प्रभावित नही करते है इनमे धन आयन तथा ऋण आयन का वही अनुपात रहता है जो क्रिष्टल के अणु सूत्र द्वारा प्रदर्शित किया जाता है इन्हें अंतर या उस्मा गतिक दोष भी कहते है
ये सामन्यत: दो प्रकार के होते है –
1:- रिक्तिका दोष 2:- अन्तराकाशी दोष
रिक्तिका दोष :- जब क्रिष्टल जालक के कुछ स्थल खली होते है तो उस दोष को रिक्तिका दोष कहते है इसके कारण पदार्थ का घनत्व कम हो जाता है इसका कारण यह है की इस दोष में पदार्थ का द्रव्यमान कम हो जाता है परन्तु आयतन वही रहता है यह दोष तब भी उत्पन हो जाता है जब पदार्थ को गर्म करते है
अन्तराकाशी दोष :- जब क्रिष्टल में अवयवी कण अन्तराकाशी स्थल ग्रहण क्र लेते है तो उसे अन्तराकाशी दोष कहते है इस दोष के कारण क्रिष्टल का घनत्व बढ़ जाता है इसका कारण यह है की इस दोष में द्रव्यमान बढ़ जाता है परन्तु आयतन स्थिर रहता है 1
#30 :- आयनिक योगिको में दोष :- आयनिक योगिको में रिक्तिका दोष या अन्तराकाशी दोष नही पाए जाते है इन्ही दोषों के समान इनमे फ्रेंकल दोष और शोटकी दोष पाए जाते है
1:- फ्रेंकल दोष :- इसमें छोटे आयन सामान्यत: धन आयन अपनी साम्य स्थिति से हटकर अन्य स्थान पर चले जाते है इससे इनकी मूल स्थति पर रिक्ति उत्पन हो जाती है तथा अन्तराकाशी स्थिति ग्रहण कर लेते है फ्रेंकल दोष रिक्तिका दोष तथा अन्तराकाशी दोष का एक युग्म है
इस दोष को विस्थापन प्रभाव भी कहते है क्योंकि इस दोष में क्रिष्टल का कोई आयन प्रथक नही होता इस कारण इस दोष में ठोस का घनत्व नही बदलता फ्रेंकल दोष वे योगिक प्रदर्शित करते है जिनकी उप्सह्सयोजन संख्या कम होती है जैसे :- ZnS , AgCl , AgBr , AgI आदि
2:-शोट्की दोष :- जिस दोष में A + B + प्रकार के आयनिक ठोस में समान संख्या में धन आयन तथा ऋण आयन लुप्त हो जाते है वह शोट्की दोष कहलाता है इस दोष में पदार्थ का घनत्व कम हो जाता है क्योंकि आयनों की संख्या घट जाती जिससे द्रव्यमान में कमी आ जाती है जबकि आयतन स्थिर रहता है जैसे :- NaCl , KCl CsCl AgBr आदि
नोट :- AgBr फ्रेंकल तथा शोट्की दनो दोष प्रदर्शित करता है 1
#31 :- अशुधि दोष :-ये दोष क्रिष्टल में कुछ बाहरी पदार्थ की उपस्थिति के कारण उत्पन होते है जैसे अपमिश्रण आदि
अपमिश्रण या डोपिंग :- किसी क्रिष्ट्लीय पदार्थ में बाह्य अशुधि की मिलावट करके क्रिष्टल के गुणों को बदलने की प्रक्रिया अपमिश्रण या डोपिंग कहलाती है 1
#32 :- नॉन स्टाचियो मिट्रिक दोष :- ये वे दोष है जो क्रिष्टल की स्टाचियो मिट्री को प्रभावोत करते है इन योगिको को धन अयनो तथा ऋण आयनों की संख्या का अनुपात आदर्श रासायनिक सूत्र की संगत नही होता यह दोष ताप बढ़ाने पर बढ़ता है छिद्रों की उपस्थिति के कारण क्रिष्टल का घनत्व कम हो जाता है ये दोष दो प्रकार के होते है
1:- धातु अधिक्य दोष 2:- धातु न्यूनता दोष
धातु अध्क्य दोष :- इस दोष में एक ऋण आयन जालक में से अपनी मूल स्थिति से हट जाता है इससे धातु धन आयनों की अधिकता हो जाती है ऋण आयन द्वारा उत्पन रिक्ति को इलेक्ट्रान ग्रहण कर लेता है ताकि वद्युत उदासीनता बनी रहे जैसे :- NaCl , में Cl आयन के निकल जाने से उत्पन रिक्ति को सोडियम द्वारा दिए गये इलेक्ट्रान से भर दिया जाता है 1
F केंद्र :- युग्मित एलेक्ट्रोनो द्वारा भरी गयी ऋण आयनिक रिक्तियों को F केंद्र कहते है इसके कारण क्रिष्टल का रंग बदल जाता है जैसे :-
NaCl के क्रिष्टल को गर्म करने पर उसका रंग पिला हो जाता है 1
इसी प्रकार KCl के क्रिष्टल को गर्म करने पर उसका रंग बैंगनी हो जाता है 1 आदि
2:- धातु न्यूनता दोष :- यह दोष तभी उत्पन होता है जब धातु परिवर्ती संयोजकता प्रदर्शित करती है यह दोष FeO , FeS , NiO आदि योगिक प्रदर्शित करते है ये योगिक विद्युत का चालन करते है
#34 :- विद्युतीय गुण :- चालकता के आधार पर ठोसो को तीन भागो में बांटा जाता है
1:- चालक 2:- विद्युत् रोधी 3:- अर्धचालक
1:- चालक :- वे ठोस जिनकी चालक ताए 10 की घात 4 से लेकर 10 की घात 7 प्रति ओम प्रति मीटर होती है चालक कहलाते है जैसे – Fe , Cu , Ag आदि
2:- विद्युत् रोधी:- वे ठोस जिनकी चालक ताए 10 की घात -20 से लेकर 10 की घात -10 प्रति ओम प्रति मीटर होती है चालक कहलाते है जैसे – लकड़ी ,रबर, प्लास्टिक आदि
3:- अर्धचालक :- वे ठोस जिनकी चालक ताए 10 की घात -6 से लेकर 10 की घात +4 प्रति ओम प्रति मीटर होती है चालक कहलाते है जैसे – सिलिकन ,जर्मेनियम आदि
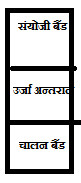
#35 :- उर्जा बैंड :- ये सामन्यत: तीन प्रकार के होते है –
1:- संयोजी बैंड 2:- चालन बैंड 3:- उर्जा अन्तराल
1:- संयोजी बैंड :- वे बैंड जो कम उर्जा वाले परमाण्विक कक्षको द्वरा बनते है संयोजी बैंड कहलाते है इसमें संयोजी इलेक्ट्रान उपस्थित होते है 1
2:- चालन बैंड :-ये बैंड खली अथवा आंशिक रूप से भरे होते हुए अधिक उर्जा वाले कक्षको द्वारा बनते है 1
3:- उर्जा अन्तराल :- यह संयोजी और चालन बैंड के मध्य उपस्थित होता है 1
CHPTER-01 PRT-05 [NOTES ]
WELCOME TO FUTURE ZONE ACADEMY
CLASS -12
CHEMISTRY CH -01 PART -05
#36:- अर्ध चालक के प्रकार :- ये सामन्यत: दो प्रकार के होते है –
1:- निज अर्ध चालक 2:- बाह्य अर्धचालक
1:- निज अर्ध चालक :- वे अर्धचालक जिनमे किसी भी प्रकार की अशुधि का अपमिश्रण नही होता है निज अर्धचालक कहलाते है 1 जैसे :- सिलिकॉन , जर्मेनियम आदि
2:- बाह्य अर्धचालक :- वे अर्धचालक जिनमे चालकता को बढ़ाने के लिए अशुधि का अपमिश्रण किया जाता है बाह्य अर्धचालक कहलाते है 1 ये सामान्यत: दो प्रकार के होते है –
1:- n प्रकार के अर्धचालक 2:- p प्रकार के अर्ध चालक
1:- n प्रकार के अर्धचालक:- वे बाह्य अर्ध चालक जिनमे वर्ग 15 के तत्व का अपमिश्रण किया जाता है जिसके कारन इनमे कार्बन परमाणु की संयोजकता पूर्ण होने के बाद एक इलेक्ट्रान शेष रह जाती है जो elctron कहलाता है n प्रकार के अर्ध चालक कहलाते है जैसे :- AsGe आदि
2:- p प्रकार के अर्धचालक :- वे बाह्य अर्ध चालक जिनमे वर्ग 13 के तत्व का अपमिश्रण किया जाता है जिसके कारन इनमे कार्बन परमाणु की एक संयोजकता शेष रह जाती है जो कोटर कहलाती है p प्रकार के अर्ध चालक कहलाते है जैसे :- GaGe आदि
नोट :- ताप का प्रभाव :- चालक में ताप बढ़ाने पर चालक की चालकता का मन घट जाता है जबकि अर्ध चालक में ताप बढ़ाने पर चालक की चालकता का मन भाद जाता है 1
#37 :- पदार्थो में चुम्कीय गुण :- सभी पदार्थो के साथ कुछ चुम्बकीय गुण सम्बन्धित होते है इनकी उत्त्पत्ति एलेक्ट्रोनो के कारण होती है इन्हें सामन्यत: 5 भागो में बांटा गया है –
1:- प्रति चुम्बकीय पदार्थ :- वे पदार्थ जिनमेअ युग्मित इलेक्ट्रान उपस्थित नही होते है और ये चुम्बकीय क्षेत्र में विपरीत दिशा में दुर्बलता से गति करते है जैसे :- NaCl , TiO , C6 H6 V2O5 आदि
2:- अनु चुम्बकीय पदार्थ :- वे पदार्थ जिनमे अयुग्मित इलेक्ट्रान उपस्थित होते है अनु चुम्बकीय पदार्थ कहलाते है और पदार्थो का यह गुण अनुचुम्बक्त्व कहलाता है जैसे :- O2 ,Cu+ Fe 3+ आदि
3:- लोह चुम्बकीय पदार्थ :- ये पदार्थ स्थायी चुम्बकत्त्व प्रदर्शित करते है ये चुम्बकीय क्षेत्र की और भुत प्रबलता से आकर्षित होते है तथा चुम्बकीय गुण चुम्बकीय क्षेत्र की अनुपस्थिति में भी प्रदर्शित करते है 1
जैसे :- Fe , Co , Ni , CrO2 आदि
4:- प्रति लोह चुम्बकीय पदार्थ :- इनमे समान संख्या में समांतर तथा विसमांतर इलेक्ट्रान उपस्थित होते है इनमे अयुग्मित इलेक्ट्रान उपस्थित होते है फिर भी इनका चुम्बकीय आघूर्ण शून्य होता है जैसे :- MnO ,, MnO2 , MnO3 V2O3 आदि
5:- फेरी चुम्बकीय पदार्थ :– इनमे असमान संख्या में समांतर तथा वि समांतर संख्या में इलेक्ट्रान उपोस्थित होते है
और परिणामी चुम्कीय आघूर्ण शून्य नही होता जैसे :- Fe3O4 , MgFe2O4 ZnFe2O4 आदि
#38:-चुम्बकीय पदार्थो पर ताप का प्रभाव :- जब किसी चुम्बकीय पदार्थ को गर्म करते है तो उसका चुम्कीय गुण समाप्त हो जाता है 1
……………………CHAPTER END …………………….
CHAPTER -02 [विलयन ]
CHAPTER-02 PART-01 [NOTES]
WELCOME TO FUTURE ZONE ACADEMY
#1:- विलयन:- दो या दो से अधिक पदार्थों का समांगी मिश्रण विलयन कहलाता है इसमें सामान्य दो घटक होते हैं एक विलेन और दूसरा विलायक
विलायक वह पदार्थ होता है जिस में विलय अर्थात कम मात्रा वाला पदार्थ घोला जाता है जैसे चीनी में पानी के विलयन में चीनी विलेय और पानी विलायक होता है
#2:- विलयन की विशेषताएं:- विलयन में निम्नलिखित विशेषताएं होती हैं-
1:- विलयन में केवल एक ही पर प्रवस्था होती है
2:- विलन एक समांगी मिश्रण होता है
3:- विलयन के गुण उसके घटकों पर निर्भर करते हैं
4:- विलयन का संगठन एक निश्चित सीमा तक परिवर्तित किया जा सकता है
# 3 :- विलयन के प्रकार:- विलयन केवल नौ प्रकार के ही संभव है- क्योंकि तीन प्रकार के विलयन गैसीय विलयन होते हैं होते हैं , तीन प्रकार के विलयन द्रव विलयन और तीन प्रकार के ठोस विलयन होते हैं
note:- जलीय विलयन को aqueous solution कहते हैं जबकि अजलीय विलयन को non aqueous solution कहते हैं
#4:- विलयन की सांद्रता व्यक्त करना :- विलयन की सांद्रता को निम्न प्रकार से व्यक्त किया जा सकता है-
1:- ग्राम प्रति लीटर में सांद्रता(g/l):- 1 लीटर विलियन में उपस्थित विलय पदार्थ की ग्राम में मात्रा ग्राम प्रति लीटर में सांद्रता कहलाती है अर्थात
ग्राम प्रति लीटर में सांद्रता(g/l)= विलेय का ग्राम में भार / विलयन का लीटर में आयतन
2:- द्रव्यमान प्रतिशतता:- 100 ग्राम विलियन में उपस्थित ब्द विलेय पदार्थ की ग्रामों में संख्या उसकी द्रव्यमान प्रतिशतता कहलाती है अर्थात –
द्रव्यमान प्रतिशतता = विलेय का द्रव्यमान / विलयन का द्रव्यमान
यदि आपको कहा जाए कि 10 प्रतिशत NaCl इसका अर्थ यह होता है कि 10 ग्राम NaCl और 90 ग्राम जल है
3:- आयतन प्रतिशतता :- 100 ml विलियन में उपस्थित विलेय पदार्थ के ml में संख्या उसकी आयतन प्रतिशतता कहलाती है अर्थात –
आयतन प्रतिशतता = विलेय का आयतन / विलयन का आयतन
यदि आपको कहा जाए कि 10 प्रतिशत NaCl आयतन अनुसार इसका अर्थ यह होता है कि 10ml NaCl और 90 ml जल है
4:- नॉर्मलता :- 1 लीटर विलयन में उपस्थित विलेय के ग्राम तुल्यानको की संख्या नॉर्मलता कहलाती है अर्थात-
नोर्मलता = विलेय के ग्राम तुल्यानको की संख्या / विलयन का कुल आयतन
नोट:- ग्राम तुल्यांक = विलेय का भार / तुल्यंकी भार
तुल्यंकी भार = पदार्थ का भार / पदार्थ की संयोजकता
5:-मोलरता :- एक लीटर विलयन में उपस्थित विलेय के मोलो की संख्या उस विलयन की मोलरता कहलाती है इसे M से प्रदर्शित करते है
अर्थात:- मोलरता = विलेय के मोलो की संख्या / विलयन का आयतन लीटर में
नोट :- मोल = विलेय का भार /विलेय का मोलर द्रव्यमान
6:-मोललता :-एक किलोग्राम विलायक में उपस्थित विलेय के मोलो की संख्या उस विलयन की मोललता कहलाती है इसे m से प्रदर्शित करते है
अर्थात:- मोललता = विलेय के मोलो की संख्या / विलायक का भार किलोग्राम में
7:- फोर्मालता :- एक लीटर विलियन में उपस्थित सूत्र द्र्व्यमानो की संख्या फोर्मलता कहलातीं है अर्थात –
फोर्मलता = विलेय के सूत्र द्र्व्यमानो की संख्या / विलयन का आयतन लीटर में
8:- मोल प्रभाज :- विलयन में उपस्थित किसी एक घटक के मोलो की संख्या और विलयन में उपस्थित कुल मोलो की संख्या के अनुपात को उस घटक का मोल प्रभाज कहते है अर्थात –
यदि विलयन में उपस्थित सभी घटकों की संख्या 2 हो तो इनमे से पहला घटक A , दूसरा घटक B के मोलो की संख्या क्रमश: nA व nB होने पर
A का मोल प्रभाज (XA) = A के मोल / (A के मोल +B के मोल ) = nA / (nA + nB )
CHAPTR-02 PART-02 [NOTES]
WELCOME TO FUTURE ZONE ACADEMY
#8:- पार्ट्स पर मिलियन:- 1 लीटर विलयन में उपस्थित विला के मिली ग्रामों की संख्या पार्ट्स पर मिलयन कहलाती है इसे सामान्य रूप में ppm में सांद्रता कह देते है –
अर्थात :- ppm = विलय का मिलीग्राम में द्रव्यमान / विलयन का लीटर में आयतन
नोट:- विलयन की नोर्मलता और मोलरता में सम्बन्ध :-
नोर्मलता = मोलरता x n
जहाँ n अम्ल की क्षारता और क्षार की अम्लता है जैसे :- HCl , NaOH आदि के लिए n = 1 होता है
#:- नोर्मलता समीकरण :- माना किसी विलयन की नोर्मलता N 1 तथा आयतन V 1 है इस विलयन को तनु करने पर आयतन V2 हो जाये तथा नोर्मलता N 2 हो जाती है तब –
N1V1 = N2V2
यही समीकरण नोर्मलता समीकरण कहलाती है
#:- मोलरता समीकरण :- माना किसी विलयन की मोलरता M1 तथा आयतन V1 है इस विलयन को तनु करने पर आयतन V2 हो जाये तथा मोलरता M2 हो जाती है तब –
M1V1 = M2V2
यही समीकरण मोलरता समीकरण कहलाती है
#:- विलेयता :- स्थिर ताप पर संतर्प्त विलयन बनाने के लिए 100 ग्राम विलायक में विलय पदार्थ की ग्राम में जितनी अधिकतम मात्रा घोली जा सकती है उसे उस पदार्थ की विलेयता कहते है 1
#:- संतर्प्त विलयन :- एसा विलयन जिसमे ताप और दब की स्थिर अवस्था मर और अधिक विलय पदार्थ नही घोला जा सकता है संतर्प्त विलयन कहलाता है इस अवस्था में कुछ कण आपस में जुडकर एक ठोस पदार्थ का रूप ले लेते है जिसे क्रिश्त्लं कहते है
नोट:- like dissolves like ये एक एसा सिद्धांत है जिससे पता लगाया जाता है की कोन सा पदार्थ किस में घुल जाता है क्योंकि एक जैसे प्रक्रति के ही आपस में घुलते है
#:- द्रव विलायको में ठोस की विलायता को प्रभावित करने वाले कारक :-
1:- ताप का प्रभाव :- सामन्यत: ताप बढ़ाने पर अभिक्रिया की विलेयता घटती है परन्तु फिर भी यह इस बात पर निर्भर करती है की अभी क्रिया ऊष्मा शोषी है या ऊष्मा क्षेपी यदि ऊष्मा शोषी है तो बढती है अन्यथा घटती है
2:- दब का प्रभाव :- इसका विलेयता पर कोई परभाव नही पड़ता है 1
#:- गैसों की द्रव में विलेयता :- कई गैसे द्रव में घुल जाती है जैसे सोडावाटर तथा शीतल पेय पदार्थो में जल में उछ दब पर CO2 गैस घुल जाती है – फिर भी इनकी विलेयता इस बात पर निर्भर करती है की –
1:- गैस की प्रक्रति :- H2 , N 2 , और O2 आदि गैसे जल में भुत कम घुलती है जबकि CO2 NH3 ,आदि भुत ज्यादा घुल जाती है
2:- ताप का प्रभाव :- गैसों की विलेयता ताप बढ़ाने पर सदैव घटती है 1
3 :- द्रव विलायक की प्रक्रति :- ताप तथा दब की परिस्थतियो में O2 N 2 आदि गैसे जल में घोली जा सकती है जबकि सामान्य स्थिति में ये बहुत कम घुलती है
#:- हेनरी का नियम :- इस नियम के अनुसार नियत ताप पर विलयन के उपर किसी गैस का आंशिक दब (p ) विलयन में विलीन गैस के मोल प्रभाज के समानुपाती होता है अर्थात :-
p α x
अत: p = K H x जहाँ K H एक नियतांक है इसका मात्रक दाब के समान होता है
#:- हेनरी के नियम के अनुप्रयोग :-
1:- शीतल पेय पदार्थो में CO2 की विलेयता को बढ़ाने के लिए बोतलों को उच्च दाब पर शील किया जाता है
2:- ऊँचे स्थानों पर रहने वाले लोगो को साँस लेने में थोड़ी परेशानी होती है क्योंकि इन स्थानों पर O2 की सांद्रता कम होती है इससे व्यक्ति में कमजोरी आने लगती है इस बीमारी को एनोकसिया कहते है 1
3:- समुद्र में निचे गहराई में जाने पर दाब बढ़ जाता है जिसके कारन N 2 जैसे गैसे रक्त में घुलने लगती है जिससे तंत्रिका की स्वेदना खत्म होने लगती है इस बीमारी को बेंड्स कहते है
#:-हेनरी के नियम की सीमाए :-
1:- दाब अधिक न हो
2:- ताप बहुत कम न हो
3:- गैस बहुत अधिक घुलन शील न हो
#:- शुद्ध द्रवों का वाष्प दाब :- वाष्प तथा द्रव की सम्य्वस्था में स्थिर ताप पर वाष्प द्वारा डाला गया दाब द्रव का वाष्प दाब कहलाता है 1
यह निम्न बातो पर निर्भर करता है :-
1:- ताप बढ़ाने पर द्रव का वाष्प दाब बढ़ता है
2:- स्थिर तापमान पर इसका मान अपरिवर्तित रहता है
3:- समान ताप पर जिन विलयनो का वाष्प दाब समान होता है उन्हें समदाबी विलयन कहते है
#:- ठोस पदार्थो का द्रव में विलयन एवं विलयन का वाष्प दाब :- जब किसी विलयन में अवाष्पशील पदार्थ मिलाया जाता है तो उसका दाब घट जाता है वाष्प दाब की इसी कमी को वाष्प दाब का अवनमन कहते है 1
CHAPTER-02 PART-03 [NOTES]
WELCOME TO FUTURE ZONE ACADEMY
#:- राऊल्ट का नियम :- इस नियम के अनुसार विलयन में उपस्थित घटक का आंशिक वाष्प दाब उसके मोल प्रभाज के अनुक्रमानुपति होता है अर्थात :-
यदि किसी विलयन के घटक A व B है जिनका वाष्प दब क्रमश: P A व P B है और इनके मोल प्रभाज क्रमश: X A व X B हो तब
CHPATER-02 PART-04 [NOTES]
WELCOME TO FUTURE ZONE ACADEMY
#1:- अणुसंख्य गुण :- विलयन के वे भोतिक गुण जो विलयन के एक दिए हुए आयतन में केवल विलय के कणों की संख्या पर निर्भर करते है –
कुछ महत्वपूर्ण अणु संख्य गुण निम्नलिखित है –
a:- वाष्प दाब का आपेक्अषित वनमन
b:- कवथनाक का उन्नयन
c:- हिमांक का अवनमन
d:- परासरण दाब
आइये निचे से एक एक हैडिंग लेकर जाते है –
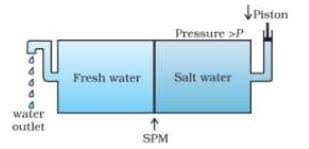
#:- परासरण :- विलायक का कम मोलर सांद्रता के विलयन से अधिक मोलर सांद्रता के विलयन की तरफ अर्ध पारगम्य झिल्ली में से स्वत: प्रवाह परासरण कहलाता है 1
नोट:- अर्ध पारगम्य झिल्ली :- इसे सामान्यत: spm कहते है 1 यह वह झिल्ली होती है जो कम मोलर सांद्रता के विलयन को अधिक मोलर सांद्रता के विलयन में स्वत: प्रवाह होने देती है 1
जैसे :- goats bllader , अंडे की झिल्ली , जीवित कोशिका की भित्ति , पर्चेमेंट सल्लोफोंन आदि
कृत्रिम रूप से बनी हुई spm क्युप्रिक फेरोसाइनैड है
#:- परासरण दाब :- किसी विलयन को अर्ध पारगम्य झिल्ली द्वारा विलायक से प्रथक रखने पर विलयन में विलायक के प्रवेश को रोकने के लिए विलयन पर लगाया गया अतिरिक्त दाब विलयन का परासरण दाब कहलाता है इसे π से प्रदर्शित करते है इसे सामान्यत: निम्न समीकरण से ज्ञात करते है –
π = CRT
जहाँ C मोल प्रति लीटर में सांद्रता है , R एक गैस नियतांक है जबकि T तापमान होता है
#:- समपरासरी विलयन :- स्थिर ताप पर एसे विलयन जिनके परासरण दाब समान होते है समपरासरी विलयन कहलाते है इनकी मोलर सांद्रता भी समान होती है
#:- अतिपरासरी विलयन :- वे विलयन जिनके परासरण दाब किसी अन्य विलयन के परासरण दाब से अधिक होता है अति परासरी विलयन कहलाते है 1
#:- अल्प परासरी विलयन :- वे विलयन जिनके प्रसारण दाब किसी अन्य विलयन के परासरण दाब से कम होते है अल्प परासरी विलयन कहलाते है 1
#:- विसरण :- किसी [पदार्थ का उछ सांद्रता से निम्न संद्ता की और प्रवाह विसरण कहलाता है 1 इसके लिए किसी अर्ध पारगम्य झिल्ली की आवश्यकता नही पडती है यह सभी विलयनो में सम्भव होता है जबकि परासरण नही
CHAPTER-02 PART-05[NOTES]
WELCOME TO FUTURE ZONE ACADEMY